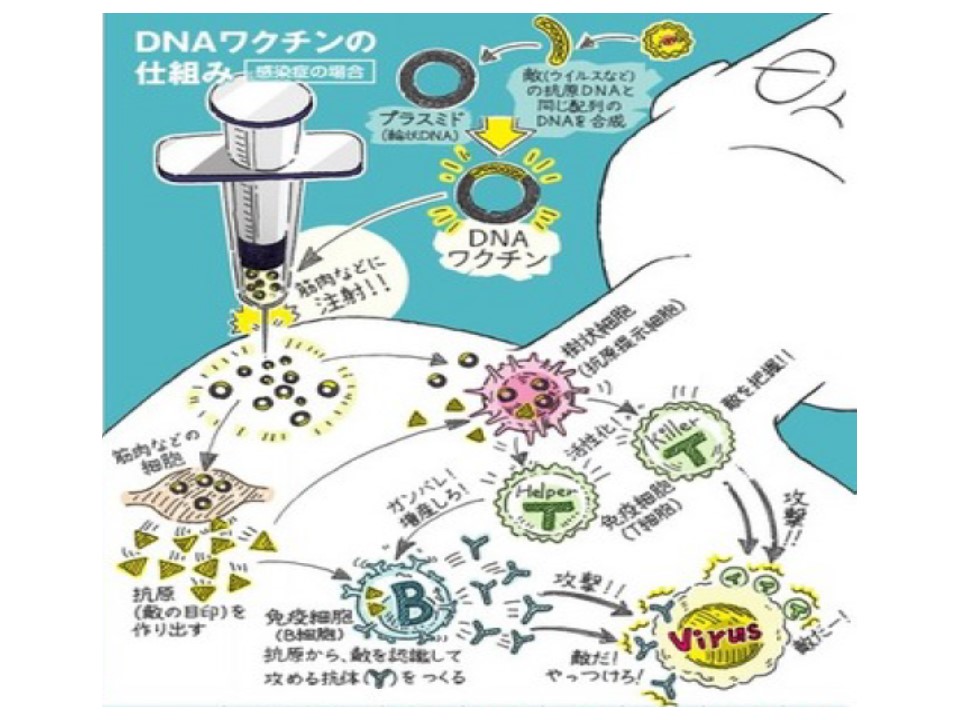
DNAワクチン接種(DNAワクチンせっしゅ)あるいはDNAワクチン投与(DNAワクチンとうよ)は、特定の抗原のDNAコード配列を免疫化された種の細胞にトランスフェクトする技術である。
DNAワクチンは、免疫応答が求められる抗原をコードするDNA配列を含む遺伝子操作されたプラスミドを注入することによって機能するため、細胞は直接、抗原を産生し、防御免疫応答を引き起こす。DNAワクチンには、より広範囲の免疫応答タイプを誘発する能力など、従来のワクチンに比べて理論上の利点があるとされる。いくつかのDNAワクチンが獣医用にテストされている。動物の疾患において効果が得られている場合とそうでない場合がある。2016年8月の時点で、米国ではヒトへの使用が承認されたDNAワクチンはない。ヒトのウイルス性、細菌性、寄生虫性疾患、および癌(がん)に対するアプローチについての研究が進行中である。
歴史
DNAワクチンはいわゆる「第3世代ワクチン」である。100年以上の間、ワクチン接種は免疫系を刺激するため免疫系が直接反応する特定の抗原を導入するか、病気を引き起こすことなく宿主内で複製し、抗原を合成できる弱毒化した感染性の病原体を導入するかのいずれかのアプローチによって影響を受けてきた。そして、ワクチン接種に対する根本的に新しいアプローチが開発された。
DNAワクチンには、病原体からの特定のタンパク質(抗原)をコードするDNAが含まれ、DNAは体内に注入され、細胞に取り込まれるとされる。細胞の通常の代謝プロセスは、取り込んだプラスミドの遺伝暗号に基づいてタンパク質を合成する。これらのタンパク質には細菌やウイルスに特徴的なアミノ酸配列の領域が含まれているため、外来性として認識され、宿主細胞によって処理されて表面に表示されると、免疫系に警告が発せられ、免疫反応が引き起こされる。あるいは、細胞の取り込みを容易にするために、DNAをタンパク質にカプセル化する。このキャプシドタンパク質がDNAに含まれている場合、得られるワクチンは、復帰のリスクなしに生ワクチンの効力を組み合わせることにある。
1983年、ニューヨーク州保健局のEnzoPaolettiとDennisPanicaliは、遺伝子工学を使用して通常の天然痘ワクチンを他の病気を予防できるワクチンに変換することにより、組換えDNAワクチンを製造する戦略を考案した。彼らは、他のウイルス(単純ヘルペスウイルス、B型肝炎、インフルエンザ)の遺伝子を挿入することにより、牛痘ウイルスのDNAを改変した。1993年、JeffreyUlmerとMerckResearch Laboratoriesの同僚は、インフルエンザ抗原をコードするプラスミドDNAをマウスに直接注射すると、インフルエンザウイルスによるその後の実験的感染から動物が防御されることを実証した。2016年に、ジカウイルスのDNAワクチンが国立衛生研究所でヒトでのテストを開始した。この研究は、18歳から35歳までの最大120人の被験者を対象に計画された。別々に、InovioPharmaceuticalsとGeneOneLife Scienceは、マイアミでジカ熱に対する異なるDNAワクチンのテストを開始した。 NIHワクチンは高圧下で上腕に注射される。 2016年8月の時点で、大量のワクチンの製造方法は未解決のままであった。 HIVを予防するためのDNAワクチンの臨床試験が進行中である。
アプリケーション
米国では、ヒトでの使用が承認されているDNAワクチンは存在していない。病気から身を守るのに十分な強さの反応を引き起こした実験的試験はほとんどなく、この技術の有用性は人間で証明されていない。ウエストナイルウイルスから馬を防御するための獣医用DNAワクチンが承認されている。抗毒素血清を開発する手段として、DNA免疫も研究されている。DNA免疫は、モノクローナル抗体誘導の技術プラットフォームとして使用できる。
利点
- 感染のリスクなし
- MHCクラスI分子とクラスII分子の両方による抗原提示
- タイプ1またはタイプ2に向けてT細胞応答を極性化する
- 目的の抗原に焦点を当てた免疫反応
- 開発と生産の容易さ
- 保管と出荷の安定性
- 費用対効果
- ペプチド合成、組換えタンパク質の発現と精製、および毒性アジュバントの使用の必要性を排除
- 免疫原の長期持続性
- インビボでの発現は、タンパク質が通常の真核生物の構造により近く、翻訳後修飾を伴うことを保証
有害な影響
- タンパク質免疫原に限定される(細菌性多糖類などの非タンパク質ベースの抗原には有用ではない)
- 細胞増殖を制御する遺伝子に影響を与えるリスク
- DNAに対する抗体産生を誘導する可能性
- 産生された抗原(タンパク質)に対する耐性の可能性
- 細菌および寄生虫タンパク質の非定型処理の可能性
- プラスミドDNAナノ粒子の鼻スプレー投与を使用して、脳細胞などの非標的細胞をトランスフェクトする場合の可能性
プラスミドベクター
ベクターデザイン
DNAワクチンは、高活性の発現ベクターを使用した場合に最良の免疫応答を引き出す。これらは通常、目的の遺伝子(または相補的DNA)のinvivo転写および翻訳を駆動する強力なウイルスプロモーターからなるプラスミドである。イントロンは、mRNAの安定性を改善し、タンパク質の発現を増加させるために含まれる場合がある。プラスミドには、ウシ成長ホルモンやウサギのベータグロブリンポリアデニル化配列などの強力なポリアデニル化/転写終結シグナルも含まれている。ポリシストロン性ベクター(複数のゲノム部位に位置するもの)は、複数の免疫原を発現するため、または免疫原と免疫刺激タンパク質を発現するために構築されることがある。
プラスミドは免疫原が発現される「媒体」であるため、最大のタンパク質発現のためにベクターデザインを最適化することが不可欠である。タンパク質発現を増強する1つの方法は、真核細胞の病原性mRNAのコドン使用頻度を最適化することである。病原体はしばしば標的種とは異なるAT含有量を持っているため、免疫原の遺伝子配列を変更して、標的種でより一般的に使用されるコドンを反映させると、その発現が改善される可能性がある。
別の考慮事項は、プロモーターの選択である。 SV40プロモーターは、ラウス肉腫ウイルス(RSV)プロモーターによって駆動されるベクターの発現率がはるかに高いことが研究で示されるまで、従来から使用されていた。最近では、サイトメガロウイルス(CMV)の前初期プロモーターを使用することで発現率がさらに上昇している。メイソンファイザーモンキーウイルス(MPV)-CTEを含めると、revの有無にかかわらずエンベロープ発現が増加する。さらに、CTE revコンストラクトはCTE単独ベクターよりも免疫原性が有意に高い。発現率を改善するための追加の修飾には、エンハンサー配列、合成イントロン、アデノウイルス三者リーダー(TPL)配列の挿入、およびポリアデニル化および転写終結配列への修飾が含まれる。DNAワクチンプラスミドの例は、SV40プロモーターを使用するpVACである。
構造的不安定現象は、プラスミド製造、DNAワクチン接種および遺伝子治療にとって特に懸念される。プラスミドバックボーンに関連するアクセサリー領域は、広範囲の構造的不安定性現象に関与している可能性がある。遺伝的不安定性のよく知られた触媒には、直接、逆方向、およびタンデムリピートが含まれ、これらは多くの市販のクローニングおよび発現ベクターで顕著である。したがって、無関係な非コードバックボーン配列の減少または完全な排除は、そのようなイベントが起こる傾向を著しく減少させ、その結果、プラスミド全体の組換えの可能性を減少させる可能性がある。
プラスミドのメカニズム
プラスミドがトランスフェクトされた細胞核に挿入されると、外来抗原のペプチドストリングをコードする。その表面に、細胞は組織適合遺伝子複合体(MHC)クラスIとクラスII分子の両方を持つ外来抗原を表示する。次に、抗原提示細胞はリンパ節に移動し、T細胞によってシグナル伝達された抗原ペプチドと共刺激分子を提示し、免疫応答を開始する。
ワクチン挿入のデザイン
免疫原は、抗体または細胞傷害性T細胞の応答を改善するために、さまざまな細胞内コンパートメントを標的にする。分泌型または原形質膜結合型の抗原は、細胞質ゾルの抗原よりも抗体反応の誘導に効果的であるが、細胞傷害性T細胞の反応は、抗原を細胞質分解およびその後の主要な組織適合性の複合体(MHC)クラスI経路への侵入に標的化することで改善する。これは通常、N末端ユビキチンシグナルの追加によって達成される。
タンパク質のコンフォメーションも抗体反応に影響を与える可能性がある。 「秩序だった」構造(ウイルス粒子など)は、秩序のない構造よりも効果的である。さまざまな病原体に由来する一連のミニ遺伝子(またはMHCクラスIエピトープ)は、特にTHエピトープも含まれている場合、一部の病原体に対する細胞傷害性T細胞の応答を引き起こす。
デリバリー
DNAワクチンは複数の方法で動物組織に導入されている。最も人気のある2つのアプローチは、1999年に生理食塩水中のDNAを標準的な皮下注射針を使用することであった。または遺伝子銃を使用することもある。他のいくつかの技術は、その間に文書化されている。
生理食塩水の注射
生理食塩水の注射は通常、骨格筋の筋肉(IM)または皮下(ID)で行われ、細胞外の空間にDNAを送達します。これは、1)エレクトロポレーションによって; 2)ブピバカインなどの筋毒素で筋線維を一時的に損傷することによって支援することができる。または3)生理食塩水またはショ糖の高張液を使用する。この方法に対する免疫反応は、針の種類、針の位置合わせ、注射の速度、注射の量、筋肉の種類、およびレシピエントの年齢、性別、生理学的状態などの要因によって影響を受ける可能性がある。
遺伝子銃
遺伝子銃による送達は、加速剤として圧縮ヘリウムを使用して、金またはタングステンの微粒子に吸収されたプラスミドDNA(pDNA)を弾道的に加速する。
粘膜表面に送達
代替案には、鼻粘膜や肺粘膜などの粘膜表面へ裸のDNAのエアロゾル注入や、眼および膣粘膜へのpDNAの局所投与が含まれている。粘膜表面へ送達させる方法としては、カチオン性リポソーム-DNA調製物、生分解性ミクロスフェア、弱毒化サルモネラ菌、腸粘膜への経口投与用の赤痢菌またはリステリアベクターおよび組換えアデノウイルスベクターを使用して達成されています。
ポリマービークル
DNAワクチンの送達には、細菌細胞と合成ポリマーで構成されるハイブリッドビークルが採用されている。大腸菌の内核とポリ(ベータ-アミノエステル)の外皮は相乗的に機能し、細胞の取り込みと内在化、ファゴソームの脱出、細胞内の積荷濃度など、抗原提示細胞の遺伝子送達に関連する障壁に対処することで効率を高めます。マウスでテストしたところ、ハイブリッドベクターは免疫反応を誘発することがわかった。
ELI予防接種
DNAワクチン接種への別のアプローチは免疫発現ライブラリー(ELI)である。この技術を使用すると、病原体からのすべての遺伝子を一度に送達できる可能性があり、これは弱毒化または培養が困難な病原体に役立つ可能性がある。ELIは、どのような遺伝子が個体を防御するための反応を誘発するかを特定するために使用できる。これは、比較的小さなゲノムを持つマウスの肺病原体であるMycoplasmapulmonisでテストされている。部分的な発現ライブラリーでさえ、その後の実験チャレンジから、防御を誘発するとした期待をもたらせている。
比較
投与量
送達させるやり方として効果的な免疫応答を高めるために必要な用量を決定する。生理食塩水の注射は10μgから1mgまでのさまざまな量のDNAを必要とするが、遺伝子銃の送達は100から1000分の1を必要としている。一般に、0.2μg〜20μgが必要とするが、16ngという少量が報告されている。これらの量は種によって異なり、たとえば、マウスは霊長類の約10分の1のDNAを必要とする。生理食塩水の注射は、DNAが標的組織(通常は筋肉)の細胞外空間に送達されるため、より多くのDNAを必要とする。そこでは、DNAが取り込まれる前に、物理的障壁(基底膜や大量の結合組織など)を克服する必要がある。遺伝子銃の送達がDNAを直接細胞に駆動/強制する一方で、「無駄」が少なくなっている。
免疫反応
ヘルパーT細胞応答
DNA免疫は、リンパ増殖やさまざまなサイトカインプロファイルの生成など、複数のTh応答を引き起こす可能性があります。 DNAワクチンの主な利点は、ヘルパーT細胞のTh1またはTh2応答に偏らせるためにそれらを操作することが容易である。それぞれのタイプには、リンホカインとケモカインの発現の特徴的なパターン、特定のタイプの免疫グロブリン、リンパ球輸送のパターン、および自然免疫応答のタイプがある。
他のタイプのヘルパーT細胞
発生するヘルパーT細胞のタイプは、送達方法と発現する免疫原のタイプ、およびさまざまなリンパ系コンパートメントの指標によって影響を受ける。一般に、生理食塩水の針注射(IMまたはIDのいずれか)はTh1応答を誘発する傾向がありますが、遺伝子銃による送達はTh2応答を上昇させる。これは、細胞内および原形質膜に結合した抗原には当てはまりますが、送達方法に関係なく、Th2応答を生成すると思われる分泌抗原には当てはまらない。
一般に、発生するヘルパーT細胞のタイプは時間の経過とともに安定しており、これは通常、ナイーブな標本では反対のタイプの応答を引き起こし、立ち向かったときや、その後の予防接種後に変化はしない。ところが、Moretおよびその他の者たち(1995)は、マウスマラリア原虫Plasmodium yoelii(PyCSP)のスポロゾイト周囲のタンパク質をコードするpDNAでマウスを免疫化して、さらに追加免疫後、最初のTh2応答がTh1応答に変化することを発見した。
様々なタイプの基底ヘルパーT細胞
これらのさまざまな方法がどのように機能するか、発現する抗原の形態、およびヘルパーT細胞のさまざまなプロファイルは理解されていない。 IM注射で使用される比較的大量のDNAがTh1応答の誘導の原因であると考えられていた。しかし、その証拠として、Thタイプに用量の関連の違いがないことを示した。発生するヘルパーT細胞のタイプは、抗原提示細胞の分化状態によって決定される。樹状細胞は分化して、IL-12(Th1細胞の発達をサポートする)またはIL-4(Th2応答をサポートする)を分泌することができる。針によって注入されたpDNAは樹状細胞にエンドサイトーシスされ、樹状細胞は刺激されてTh1サイトカイン産生のために分化する。一方、遺伝子銃はDNAを細胞に直接衝突させ、Th1刺激をバイパスする。
極性化ヘルパーT細胞の実用化
ヘルパーT細胞の分極化は、アレルギー反応や自己免疫疾患に影響を与えるのに役立つ。自己免疫疾患の目標は、自己破壊的なTh1応答(関連する細胞傷害性のT細胞活性を伴う)を非破壊的なTh2応答にシフトすることである。これは、前臨床モデルにおける望ましいタイプの反応の疾患前プライミングにうまく適用されており、確立された疾患の反応をシフトすることに、ある程度成功している。
細胞傷害性のT細胞の応答
DNAワクチンの利点の1つは、生ワクチンに伴う固有のリスクなしに細胞傷害性のTリンパ球(CTL)を誘導できることです。 CTL応答は、免疫優勢および免疫劣性のCTLエピトープ、および亜優勢のCTLエピトープに対して、自然感染を模倣しているように見える方法で発生させることができます。これは、CTLエピトープと免疫を提供する上でのそれらの役割を評価する上で有用なツールであることが証明される可能性がある。
細胞傷害性のT細胞は、MHCクラスI分子と複合体を形成した小さなペプチド(8〜10アミノ酸)を認識する。これらのペプチドは、分解されて小胞体内の新生MHCクラスI分子に送達される内因性サイトゾルタンパク質に由来する。したがって、遺伝子の産物を直接ERにターゲティングする(アミノ末端挿入配列を追加することにより)と、CTL応答が増強される可能性がある。これは、インフルエンザタンパク質を発現する組換えワクシニアウイルスを使用して成功をおさめて実証されたが、この原理はDNAワクチンにも適用できる可能性がある。ユビキチンシグナル配列の追加または他のシグナル配列の突然変異による細胞内分解(したがってMHCクラスI経路への侵入)のための抗原の標的化は、CTL応答の増加に効果的であることが示された。
CTL応答は、インフルエンザ核タンパク質に対するDNAワクチンの場合はB7-1またはB7-2などの共刺激分子、またはマウスマラリアモデルP.yoeliiに対するDNAワクチンの場合はGM-CSFとの共接種によって増強できる。共刺激分子IL-12およびTCA3をコードするプラスミドとの同時接種は、HIV-1およびインフルエンザ核タンパク質抗原に対するCTL活性を増加させることが示された。
体液性(抗体)反応
DNAワクチン接種によって誘発される抗体反応は、抗原の種類を含む複数の変体の影響を受けます。抗原の位置数(すなわち、細胞内対分泌)、頻度および予防接種量、抗原送達の部位および方法による。
抗体反応の動力学
DNAを1回注射した後の体液性の応答は、組換えタンパク質を1回注射した後よりもはるかに持続する可能性がある。 B型肝炎ウイルス(HBV)エンベロープタンパク質(HBsAg)に対する抗体反応は、ブーストなしで最大74週間持続したが、遺伝子銃送達後のマウスでは、インフルエンザ血球凝集素に対する防御反応の生涯にわたる維持が実証された。抗体分泌細胞は、長期にわたる抗体産生のために骨髄と脾臓に移動し、通常、1年後にも局在します。
自然(ウイルス)感染、組換えタンパク質による免疫化、およびpDNAによる免疫化によって生成された抗体応答の比較を表4に要約した。DNA発生の抗体応答は、自然感染または組換えタンパク質免疫が発生した場合よりもはるかにゆっくりと上昇する。マウスの力価がピークに達するまでに12週間もかかる場合があるが、ブーストすると間隔が短くなる可能性がある。この反応は、抗体反応の一次段階と二次段階の両方をサポートする、数週間にわたって発現される低レベルの抗原によるものとされる。 HBVの小中エンベロープタンパク質を発現するDNAワクチンを慢性肝炎の成人に注射した。ワクチンは、特定のインターフェロンによるガンマ細胞の産生をもたらした。また、ミドルエンベロープタンパク質抗原に特異的なT細胞が発現した。患者の免疫反応は、HBV感染を制御するのに十分なほど強力ではなかった。
さらに、DNAワクチン接種によって生成された特定の抗体の力価は、組換えタンパク質のワクチン接種後に得られたものよりも低くなる。ただし、DNA免疫の誘導抗体は、組換えタンパク質の誘導抗体よりもネイティブでエピトープに対して高い親和性を示す。言い換えれば、DNA免疫は質的に優れた反応を誘発する。抗体は、DNAの1回のワクチン接種後に誘導できますが、組換えタンパク質のワクチン接種には通常、追加免疫が必要である。 DNA免疫は、免疫応答のThプロファイル、したがって抗体アイソタイプにバイアスをかけるために使用が可能である。これは、自然感染または組換えタンパク質の免疫のいずれでも不可能である。 DNAによって生成される抗体反応は、準備ツールとして利用される。例えば、試薬として使用するためにポリクローナル抗体およびモノクローナル抗体を生成することが可能である。
DNA由来の基本的な免疫応答のメカニズム
DNA取り込みメカニズム
DNAの取り込みとその後の発現が筋肉細胞で最初にinvivoで実証されたとき、これらの細部はT細胞によらない特徴的なネットワークによるものと考えられていた。電子顕微鏡を使用して、DNAの取り込みがカベオラ(または、クラスリンでコーティングされていないピット)によって促進することを提案した。しかし、その後の研究により、他の細胞(ケラチノサイト、線維芽細胞、上皮ランゲルハンス細胞など)もDNAを内在化できることが明らかになった。DNA取り込みのメカニズムは解明されていなかった。
DNAのinvivo取り込みは、食作用または飲作用と同様の方法で、または特定の受容体を介して非特異的に起こるという2つの理論が支配的である。これらは、30kDaの表面受容体またはマクロファージスカベンジャー受容体が含まれる場合がある。 30kDaの表面受容体は、4500bpのDNAフラグメントに特異的に結合し(その後、内部移行)、プロのAPCやT細胞に見られる。マクロファージスカベンジャー受容体は、ポリリボヌクレオチドを含むさまざまな高分子に結合するため、DNA取り込みの候補となる。受容体を介したDNAの取り込みは、ポリグアニル酸配列の存在によって促進される可能性がある。遺伝子銃による送達システム、カチオン性リポソーム包装、および他の送達方法は、この入力方法(例えば、サイトフェクチンの必要性を減らすことによって)をバイパスしますが、それを理解することは、畜産業においてコストを削減するのに役立つ可能性がある。
骨髄由来細胞による抗原提示
キメラマウスを使用した研究では、抗原は、樹状細胞、マクロファージ、および特別な抗原提示細胞(APC)と呼ばれる特殊なB細胞を含む骨髄由来細胞によって提示されることが示されている。遺伝子銃を皮膚に接種した後、トランスフェクトされたランゲルハンス細胞は流入領域のリンパ節に移動して抗原を提示する。IMおよびID注射後、樹状細胞は流入領域のリンパ節に抗原を提示し、トランスフェクトされたマクロファージが末梢血で発見された。
樹状細胞またはマクロファージの直接トランスフェクションに加えて、クロスプライミングは、IM、ID、および遺伝子銃DNAの送達後に発生する。クロスプライミングは、骨髄由来細胞がMHCクラス1のコンテキストで別の細胞で合成されたタンパク質からのペプチドを提示するときに発生する。これは細胞毒性のT細胞の応答をプライミングでき、完全な一次免疫の応答に重要である可能性がある。
ターゲットサイトの役割
IMとIDにおけるDNAの送達は、免疫反応を異なる方法で開始する。皮膚では、ケラチノサイト、線維芽細胞、ランゲルハンス細胞が抗原を取り込み、発現し、一次の抗体反応の誘導に関与する。核酸をとりこんだランゲルハンス細胞は、皮膚から(12時間以内に)流入領域のリンパ節に移動し、そこで二次的なB細胞およびT細胞の応答を刺激する。骨格筋では、横紋筋細胞が最も頻繁に核酸を取り込むが、免疫反応には重要ではない。代わりに、IMを接種したDNAは数分以内に流入領域のリンパ節に流され、そこで遠位の樹状細胞が核酸を取り込んで免疫応答を開始する。核酸を取り込んだ筋細胞は、プロフェッショナルなAPCを輸送するための抗原の「貯蔵所」として機能することが示唆された。
免疫反応の維持
DNAワクチン接種は、強力なB細胞の刺激因子である濾胞樹状細胞(FDC)に抗原抗体の複合体を提示することにより、効果的な免疫を生成し持続する。 T細胞は、同様の胚の中心樹状細胞によって刺激される可能性がある。 FDCは、抗体産生が抗原の長期な発現と重複し、抗原と抗体の免疫複合体が形成され、FDCによって提示されるため、免疫を生成して記憶する。
インターフェロン
ヘルパーT細胞と細胞傷害性T細胞の両方が、インターフェロンを分泌することによってウイルス感染を制御できる。細胞傷害性T細胞は通常、ウイルスに感染した細胞を破壊する。ただし、IFN-γやTNF-αなどの抗ウイルスのサイトカインを分泌するように刺激することができる。これらは細胞を破壊せずに、ウイルス成分の発現をダウンレギュレートすることによってウイルス感染を制限する。DNAワクチン接種は、非破壊的なIFNを介した制御によってウイルス感染を抑制するために使用できる。これはB型肝炎で実証された。IFN-γはマラリア感染の制御に非常に重要であり、抗マラリアDNAワクチンの考慮事項である。
免疫応答の調整
サイトカインの調整
効果的なワクチンは、特定の病原体に対して適切な免疫反応を誘発する必要がある。 DNAワクチンは、T細胞の助けをTh1またはTh2プロファイルに向けて極性化し、必要に応じてCTLまたは抗体を生成することができる。これは、発現される抗原の形態(すなわち、細胞内対分泌)、送達の方法および経路、または用量を変更することによって達成することができる。また、免疫調節分子、すなわちサイトカイン、リンホカインまたは共刺激分子をコードするプラスミドDNAの同時投与によって達成することができる。これらの「遺伝子アジュバント」は、次のように投与する。
- 1つは免疫原をコードし、もう1つはサイトカインをコードする2つのプラスミドの混合物
- スペーサー領域で分離された単一のバイシストロンまたはポリシストロンベクター
- プラスミドにコードされたキメラ、または融合タンパク質
一般に、炎症誘発剤(さまざまなインターロイキン、腫瘍壊死因子、GM-CSFなど)とTh2誘導サイトカインの同時投与は抗体反応を増加させる。一方、炎症誘発剤とTh1誘導性サイトカインは、体液性応答を低下させ、細胞毒性応答を増加させる (ウイルス防御においてより重要)。 B7-1、B7-2、CD40Lなどの共刺激分子が使用されることがあります。
この概念は、IL-10をコードするpDNAの局所投与に適用された。B7-1(APC上のリガンド)をコードするプラスミドは、腫瘍モデルの免疫応答を正常に増強した。GM-CSFをコードするプラスミドとP.yoeliiのスポロゾイト周囲タンパク質(PyCSP)を混合すると、その後の予防接種に対する防御が強化された(プラスミドにコードされたPyCSPだけでは強化されない)。GM-CSFにより、樹状細胞がより効率的に抗原を提示し、IL-2産生とTh細胞の活性化を促進し、免疫応答の増加を促進することが提案された。これは、最初にpPyCSPとpGM-CSFの混合物でプライミングし、続いてPyCSPを発現する組換えポックスウイルスでブーストすることによってさらに強化することができる。ただし、GM-CSF(またはIFN-γ、またはIL-2)とP. chabaudiメロゾイト表面タンパク質1(C末端)の融合タンパク質-B型肝炎ウイルス表面タンパク質(PcMSP1-HBs)をコードするプラスミドの同時注入pPcMSP1-HBのみの送達によって獲得された防御と比較して、予防接種に対する防御を取り崩す。
遺伝子アジュバントの利点は、低コストで投与が簡単であるだけでなく、不安定な組換えサイトカインや潜在的に毒性のある「従来の」アジュバント(ミョウバン、リン酸カルシウム、モノホスホリルリピドA、コレラ毒素、カチオン性およびマンナン被覆リポソーム 、QS21、カルボキシメチルセルロースおよびubenimix)など)を回避できることである。ただし、長期のサイトカイン発現の潜在的な毒性は確立されていない。多くの商業的に重要な動物種では、サイトカイン遺伝子は同定および単離されていない。さらに、さまざまなプラスミドにコードされたサイトカインは、送達時間に応じて免疫系を異なる方法で調節する。たとえば、一部のサイトカインプラスミドDNAは、免疫原pDNAの後に最もよく送達される。これは、事前または同時送達により、特異的応答が減少し、非特異的応答が増加する可能性があるためである。
免疫刺激性CpGの主旨
プラスミドDNA自体が免疫系にアジュバント効果があるとされる。細菌由来のDNAは、自然免疫防御機構、樹状細胞の活性化、およびTh1サイトカインの産生を引き起こす可能性がある。これは、免疫刺激性である特定のCpGジヌクレオチド配列の認識による。CpG刺激(CpG-S)シーケンスは、真核生物よりも細菌由来のDNAで20倍頻繁に発生する。これは、真核生物が「CpG抑制」を示すためである。つまり、CpGジヌクレオチドペアは予想よりもはるかに少ない頻度で発生する。さらに、CpG-Sシーケンスは低メチル化されている。これは細菌のDNAで頻繁に発生するが、真核生物で発生するCpGモチーフはシトシンヌクレオチドでメチル化されている。対照的に、免疫応答の活性化を阻害するヌクレオチド配列(CpG中和またはCpG-Nと呼ばれる)は、真核生物のゲノムで過剰に表されている。最適な免疫刺激配列は、2つの5 'プリンと2つの3'ピリミジンが隣接する非メチル化CpGジヌクレオチドである。さらに、この免疫刺激性ヘキサマーの外側の隣接領域は、標的細胞への結合と取り込みを確実にするためにグアニンに富んでいる必要がある。
自然免疫システムは適応免疫システムと連携して、DNAにコードされたタンパク質に対する応答を開始する。 CpG-S配列は、ポリクローナルB細胞の活性化とサイトカインの発現および分泌のアップレギュレーションを誘導する。刺激されたマクロファージはIL-12、IL-18、TNF-α、IFN-α、IFN-βおよびIFN-γを分泌し、刺激されたB細胞はIL-6および一部のIL-12を分泌する。
DNAワクチンのプラスミドバックボーンにおけるCpG-SおよびCpG-N配列の操作は、コードされた抗原に対する免疫応答の成功を確実にし、TH1表現型に向けて免疫応答を促進することができる。これは、病原体が防御のためにTH応答を必要とする場合に役立つ。 CpG-S配列は、DNAと組換えタンパク質の両方のワクチン接種の外部アジュバントとしても使用されており、成功率はさまざまである。低メチル化CpGモチーフを持つ他の生物は、ポリクローナルB細胞増殖の刺激を示している。この背後にあるメカニズムは、単純なメチル化よりも複雑である可能性がある。低メチル化マウスDNAが免疫応答を開始することは不明である。
免疫刺激性CpG配列の証拠のほとんどは、マウスの研究から得られる。このデータを他の種に外挿するには注意が必要である。スカベンジャー受容体の結合特異性は種によって異なるため、個々の種には異なる隣接配列が必要になる場合がある。さらに、反芻動物などの種は、胃腸への負荷が大きいため、免疫刺激シーケンスに鈍感である可能性がある。
代替ブースト
DNAで刺激された免疫応答は、組換えタンパク質または組換えポックスウイルスの投与によって後押しすることができる。組換えタンパク質を用いた「プライムブースト」戦略は、HIV-1エンベロープタンパク質などの弱い免疫原に対する中和抗体力価と抗体の結合力および持続性の両方を成功裏に増加させた。組換えウイルスブーストは、DNAでプライミングされたCTL応答をブーストするのに非常に効率的であることが示されている。 DNAによるプライミングは、免疫応答を必要な免疫原に集中させるが、組換えウイルスによる追加免疫は、より大量の発現抗原を提供し、特定のCTL応答の大幅な増加につながる。
プライムブースト戦略は、多くの研究でマラリアチャレンジに対する保護を誘導することに成功している。 Plasmodium yoelii circumsporozoite表面タンパク質(PyCSP)をコードするプラスミドDNAでプライミングされ、同じタンパク質を発現する組換えワクシニアウイルスで追加免疫されたマウスは、プラスミドDNAのみで追加免疫されたマウスよりも有意に高いレベルの抗体、CTL活性、IFN-γを示した。これは、組換えワクシニアウイルスで追加免疫する前に、PyCSPとマウスGM-CSFをコードするプラスミドの混合物でプライミングすることによってさらに強化することができる。サルマラリア原虫モデルP.knowlesiの効果的なプライムブースト戦略も実証されている。アカゲザルは、2つの肝臓段階抗原(スポロゾイト表面タンパク質(PkCSP)とスポロゾイト表面タンパク質2(PkSSP2))と2つの血液段階抗原(頂端メロゾイト表面タンパク質1(PkAMA1))とメロゾイト表面タンパク質1(PkMSP1p42)をコードする多成分な多段階DNAワクチンでプライミングされる。次に、4つすべての抗原をコードする組換えカナリア痘ウイルス(ALVAC-4)で追加免疫した。免疫されたサルは、スポロゾイトおよび感染した赤血球に対する抗体、およびPkCSPからのペプチドに対するIFN-γ分泌T細胞応答を具現した。スポロゾイトチャレンジに対する部分的な保護が達成され、平均寄生虫血症は対照サルと比較して有意に減少した。これらのモデルは、ヒトの熱帯熱マラリア原虫への外挿には理想的ではないが、前臨床試験では重要になる。
免疫反応の強化
DNA
DNA免疫の効率は、生分解に対してDNAを安定化し、抗原提示細胞へのDNAの送達効率を高めることによって改善できる。これは、生分解性カチオン性微粒子(セチルトリメチルアンモニウムブロミドで処方されたポリ(ラクチド-コ-グリコリド)など)をDNAでコーティングすることによって実証されている。このようなDNAでコーティングされた微粒子は、特にミョウバンと混合した場合に、組換えウイルスと同じくらい効果的にCTLを上げることができる。直径300nmの粒子は、抗原提示細胞による取り込みに最も効率的であるように思われる。
アルファウイルスベクター
組換えアルファウイルスベースのベクターは、DNAワクチン接種効率を改善するために使用されてきた。目的の抗原をコードする遺伝子がアルファウイルスレプリコンに挿入され、構造遺伝子が置き換えられるが、非構造レプリカーゼ遺伝子はそのまま残る。シンドビスウイルスとセムリキ森林ウイルスは、組換えアルファウイルスレプリコンの構築に使用されてきた。従来のDNAワクチン接種とは異なり、アルファウイルスベクターはトランスフェクトされた細胞を死滅させ、一過性に発現する。ワクチンの挿入に加えて、アルファウイルスレプリカーゼ遺伝子が発現する。アルファウイルスレプリコンがどのように免疫応答を引き起こすかは明らかではないが、このベクターによって発現される高レベルのタンパク質、レプリコン誘導サイトカイン応答、または樹状細胞による抗原の取り込みで増強につながるレプリコン誘導アポトーシスが原因である可能性がある。
脚注
参考文献
関連項目
- ベクターDNA
- HIVワクチン
- 遺伝子治療
- RNAワクチン